村居 和寿
助教 博士(保健学)
専門分野
腫瘍免疫学、感染免疫学、分子細胞免疫学、病原微生物学、分子生物学、システム生物学
研究内容
主な研究テーマ
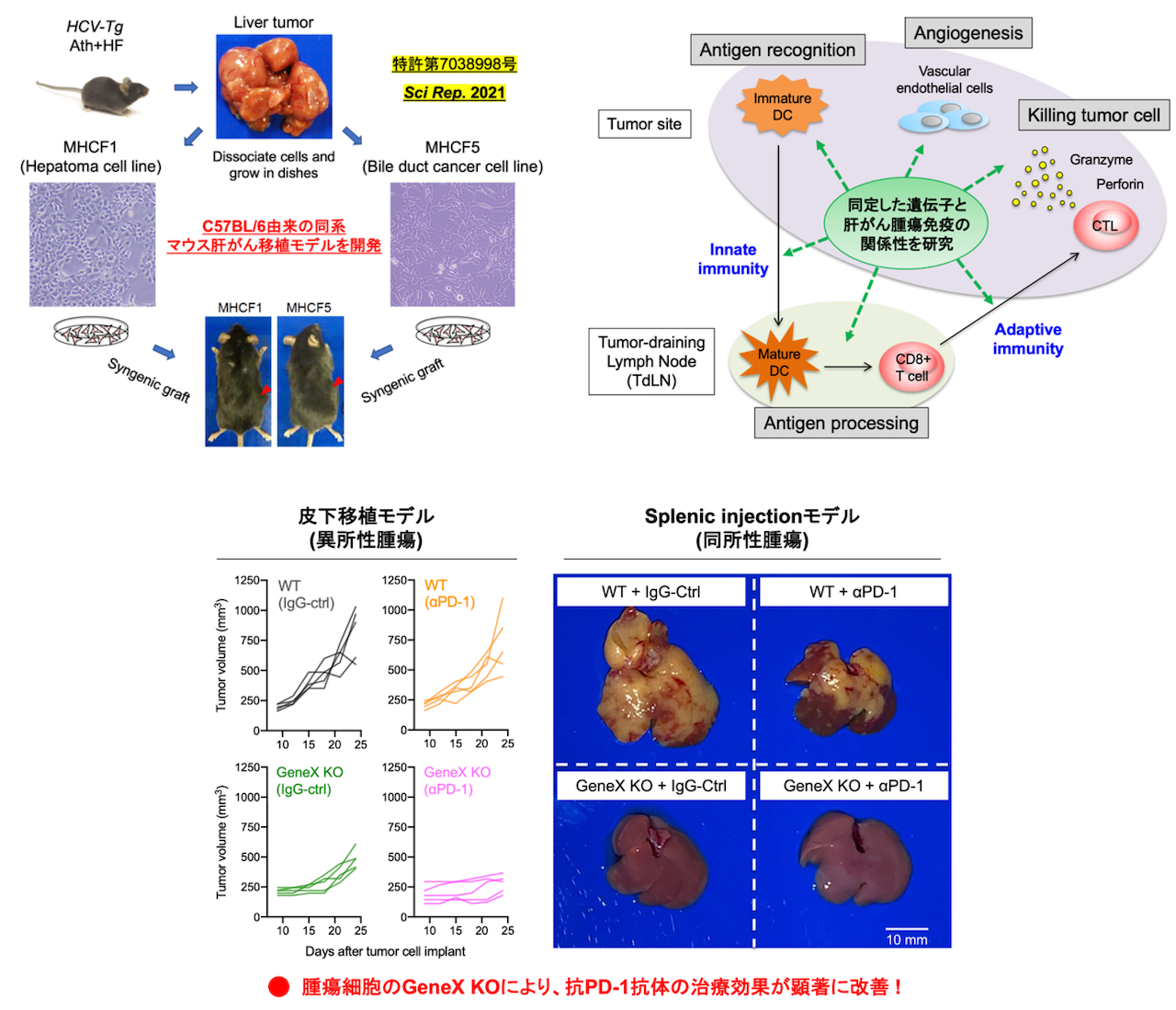
肝がん微小環境の研究基盤の確立と新規免疫治療標的の探索
免疫抑制分子PD-1/PD-L1を標的とした免疫チェックポイント阻害剤(ICI;Immune checkpoint inhibitor)は、悪性黒色腫をはじめ多種の固形がんに対し有効性を示しています。しかしながら、肝細胞がんに対するICIの治療効果は十分ではなく、最近進行肝臓がんの一次治療として認可された「アテゾリズマブ(抗PD-L1抗体)+ベバシズマブ(抗VEGF抗体)併用療法」においても奏効率は27%に留まっています。今後の肝がんに対するICI療法の課題として、治療抵抗性メカニズムの解明や、新規治療標的の探索、治療効果の期待できる症例の選択(患者層別化マーカーの同定)などが挙げられます。
現在、腫瘍免疫を評価できる肝がん移植マウスモデルは非常に少ないため、上記のような研究を思うように進めることができません。私たちは近年、世界に先駆けて、マウスを用いた異所性・同所性の肝がん移植モデル作製に有用な細胞株樹立に成功し、肝がん微小環境をマウスモデルで評価するための研究基盤を確立しました(特許第7038998号, Sci Rep. 2021)。
さらに、150例の肝癌組織のDNA chip解析から、ICI治療効果を規定する遺伝子を同定することに成功しました。今後、この遺伝子が肝がんの腫瘍免疫にどのような影響を与えているかを明らかにしていく予定です。
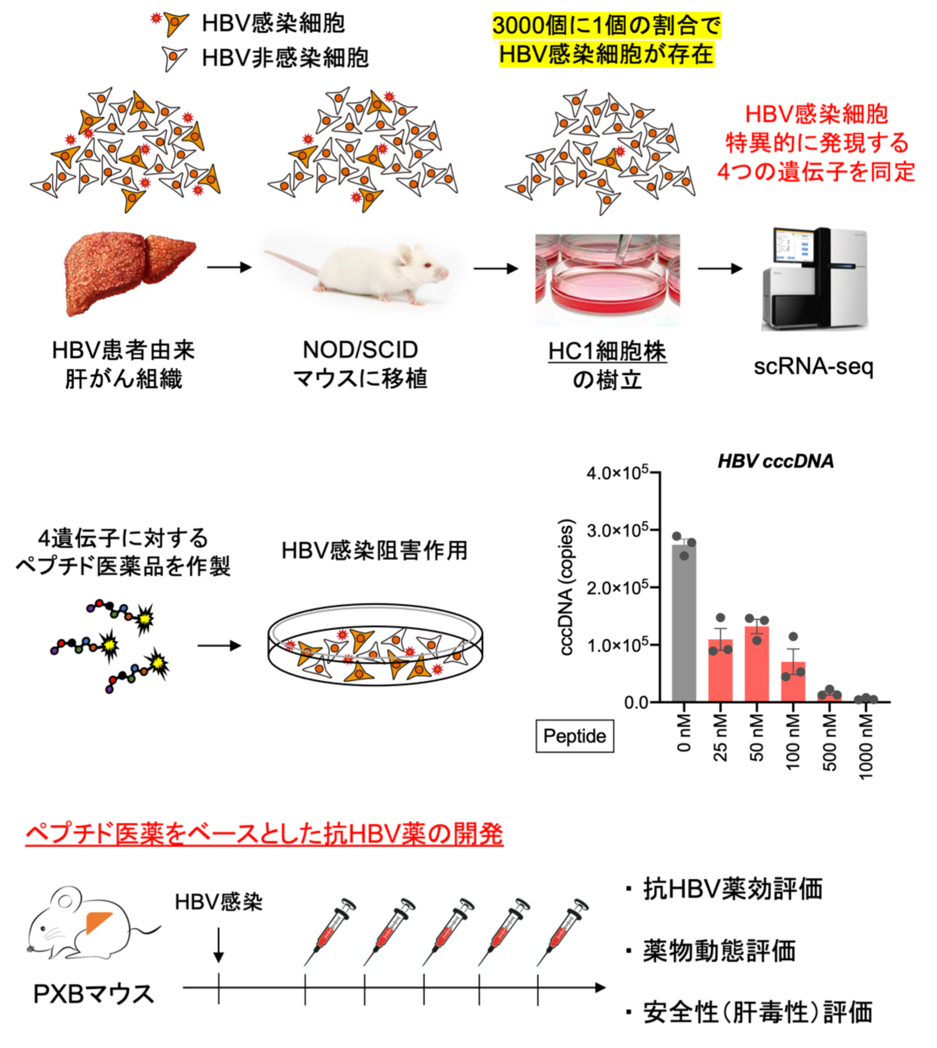
cccDNA根絶に向けた宿主因子を標的とする抗HBV薬の開発
B型肝炎ウイルス(Hepatitis B Virus;HBV)は世界に約2億4千万人ものキャリアが存在すると推定されており、その持続感染は肝硬変、肝細胞がんの発症リスクを高めます。現在、抗HBV療法にはウイルスの逆転写酵素を阻害する核酸アナログ製剤が用いられていますが、現行の治療ではHBVを感染細胞から完全に排除することはできません。そのため、HBVの完全排除を目指した新規治療法の考案が必要とされています。
私たちの研究室では、シングルセル解析(Single cell RNA-seq;scRNA-seq)により、HBV陽性細胞に特異的に発現する4つの遺伝子を同定しました。また、これらの因子を標的として作製したペプチド医薬品は顕著な抗HBV効果を示すことがわかってきています。これら4因子がHBV感染においてどのような役割を担っているかを明らかにする研究から、HBVの新たな治療薬の開発を目指しています。
これまでの業績
論文
- Functional involvement of endothelial lipase in hepatitis B virus infection.
Shirasaki T, Murai K, Ishida A, Kuroki K, Kawaguchi K, Wang Y, Yamanaka S, Yasukawa R, Kawasaki N, Li YY, Shimakami T, Nio K, Sugimoto S, Orita N, Takayama H, Okada H, huong Doan Thi Bich, Iwabuchi S, Hashimoto S, Ide M, Tabata N, Ito S, Matsushima K, Yanagawa H, Yamashita T, Kaneko S, Honda M.
Hepatology Communications. 2023 (in press) - Hepatitis B virus utilizes a retrograde trafficking route via the trans-Golgi network to avoid lysosomal degradation.
Li YY, Kuroki K, Shimakami T, Murai K, Kawaguchi K, Shirasaki T, Nio K, Sugimoto S, Nishikawa T, Okada H, Orita N, Takayama H, Wang Y, Phuong Doan Thi Bich, Ishida A, Iwabuchi S, Hashimoto S, Shimaoka T, Tabata N, Watanabe-Takahashi M, Nishikawa K, Yanagawa H, Seiki M, Matsushima K, Yamashita T, Kaneko S, Honda M.
Cell Mol Gastroenterology Hepatology. 2023;15(3):533-558. - Leukocyte cell-derived chemotaxin 2 is an antiviral regulator acting through the proto-oncogene MET.
Shirasaki T, Yamagoe S, Shimakami T, Murai K, Imamura R, Ishii KA, Takayama H, Matsumoto Y, Shirasaki N, Nagata N, Shimizu R, Yamanaka S, Abe A, Omura H, Kawaguchi K, Okada H, Yamashita T, Yoshikawa T, Takimoto K, Taharaguchi M, Takatsuka S, Miyazaki Y, Tamai T, Tanabe Y, Kurachi M, Yamamoto Y, Kaneko S, Matsumoto K, Takamura T, Honda M.
Nature Communications. 2022 Jun 8;13(1):3176.
*AMEDホームページに掲載 https://www.amed.go.jp/news/seika/kenkyu/20220629-01.html - A Single HBV Genome with a Reporter Allows the Entire Viral Life Cycle to be Monitored in Primary Human Hepatocytes.
Sumiyadorj A, Murai K, Shimakami T, Kuroki K, Nishikawa T, Kakuya M, Yamada A, Wang Y, Ishida A, Shirasaki T, Kawase S, Li YY, Okada H, Nio K, Kawaguchi K, Yamashita T, Sakai Y, Duger D, Mizukoshi E, Honda M, Kaneko S.
Hepatology Communications. 2022 6(9):2441-2454. - Establishment of liver tumor cell lines from atherogenic and high fat diet fed hepatitis C virus transgenic mice.
Shirasaki T, Murai K, Honda M, Okada H, Innami Y, Yamada A, Shimakami T, Kawaguchi K, Yamashita T, Sakai Y, Kaneko S.
Scientific Reports. 2021 Jun 22;11(1):13021 - Induction of Selenoprotein P mRNA during Hepatitis C Virus Infection Inhibits RIG-I-Mediated Antiviral Immunity.
Murai K, Honda M, Shirasaki T, Shimakami T, Omura H, Misu H, Kita Y, Takeshita Y, Ishii KA, Takamura T, Urabe T, Shimizu R, Okada H, Yamashita T, Sakai Y, Kaneko S.
Cell Host & Microbe. 2019 Apr 10;25(4):588-601.e7.
*AMEDホームページに掲載 https://www.amed.go.jp/news/release_20190411.html - Unexpected Replication Boost by Simeprevir for Simeprevir-resistant Variants in Genotype 1a Hepatitis C Virus.
Murai K, Shimakami T, Welsch C, Shirasaki T, Liu F, Kitabayashi J, Tanaka S, Funaki M, Omura H, Nishikawa T, Sumiyadorj A, Honda M, Kaneko S.
Antimicrobial Agents and Chemotherapy. 2018 Apr 16. pii: AAC.02601-17. - Peretinoin, an Acyclic Retinoid, Inhibits Hepatitis B Virus Replication by Suppressing Sphingosine Metabolic Pathway In Vitro.
Murai K, Shirasaki T, Honda M, Shimizu R, Shimakami T, Nakasho S, Shirasaki N, Okada H, Sakai Y, Yamashita T, Kaneko S.
International Journal of Molecular Sciences. 2018 Jan 23;19(2):108.
特許
- 宿主因子DENND2Aをターゲットとした抗B型肝炎ウイルス剤 (特願2022-040465)
- B型肝炎ウイルスのLIPGを介した細胞内侵入を阻害する抗B型肝炎ウイルス剤 (特願2021-121446)
- 宿主因子DOCK11をターゲットとした抗B型肝炎ウイルス剤 (特願2021-187544)
- HiBiTを利用したB型肝炎ウイルス複製モニタリングシステム (特願2020-181339)
- 細胞癌株、およびそれを用いた原発性肝癌の発症動物モデル (特許第7038998)
獲得研究費
- AMED (肝炎等克服緊急対策研究事業) (2023-2025) 代表
「がん細胞代謝の理解に基づく肝がん免疫抑制機構の本態解明」 - 科学研究費助成事業・基盤研究(B) (2023-2025) 分担
「新規モニタリング法の確立によるB型肝炎ウイルスを完全駆除する薬物の探索と同定」 - 科学研究費助成事業・若手研究 (2022-2023) 代表
「シングルセルマルチオミックス解析による肝がん微小環境の解明」 - AMED (肝炎等克服緊急対策研究事業) (2020-2022) 代表
「肝がん微小環境の研究基盤の確立と新規免疫治療標的の探索」 - 科学研究費助成事業・国際共同研究強化(B) (2020-2024) 分担
「B型・D型肝炎ウイルス共感染が引き起こす肝疾患の分子生物学的機序の解明」 - 科学研究費助成事業・若手研究 (2019-2021) 代表
「RIP-Seq法を用いたRIG-IのRNA decoy探索と核酸医薬への応用」
受賞歴
- 公益財団法人 安田記念医学財団 若手癌研究助成 (2022)
- 公益財団法人 武田科学振興財団 医学系研究助成 (2022)
- 公益財団法人 アステラス病態代謝研究会 第51回研究報告会 最優秀理事長賞 (2021)
- 北陸銀行若手研究者助成金 (2021)
- 公益財団法人 北國がん基金研究助成 (2020)
- 公益財団法人 アステラス病態代謝研究会研究助成 (2019)
- 公益財団法人「喜・榮・音與」支援財団研究助成 (2019)
- ギリアド研究助成プログラム (2018)
- GSK ジャパン研究助成 (2018)
- 国立大学臨床検査学系博士後期課程優秀賞 (2018)
- International Symposium on Hepatitis C Virus and Related Viruses 2016 Fellowship (2016)
研究室からのアピール
私たちの研究室(本多・村居 研究室)では、肝臓において克服すべき疾患である「肝細胞がん・HBV感染症」の研究に取り組んでいます。培養細胞やマウスを用いた実験に加え、臨床サンプルを用いた解析など、医学研究・創薬研究の幅広い技術・知識を習得できると思います。普段から、教員・学生間のコミュニケーションがとても盛んで、常に誰かにアドバイスをもらえる環境で研究に取り組めます。
現在、博士後期課程6人(うち留学生3人)、博士前期課程9人、卒業研究生7人、合計22名の学生が在籍しており、将来の目標も多岐にわたっています。近年は、大学院に進学したのちにバイオ系企業や製薬会社に就職する学生が増えてきており、所属する学生の約8-9割が企業就職を目指しています。また、経済的支援を受けながら博士後期課程に進学することができる、次世代精鋭人材創発プロジェクト (1名) および 博士研究人材支援・研究力強化戦略PJ予約採用 (3名) の採択者も輩出しています。
このような仲間たちと時間を共にすることで、自分の将来を真剣に考える良い機会に恵まれると思います。ぜひ私たちと一緒に研究をしてみませんか?