村居 和寿
助教 博士(保健学)
専門分野
ウイルス学、がん免疫、システム生物学
研究内容
主な研究テーマ
🔬 本多・村居 研究室へようこそ!
〜ウイルス・がん・免疫を学び、未来の医療を拓く〜
🎯 私たちのミッション:肝臓の難病に挑む!
🔍 主な研究テーマ:
- 肝がんの免疫微小環境
- 肝炎ウイルスに対する自然免疫応答
肝臓の病気は、日本でも世界でも多くの人が苦しんでいる重大な課題です。
私たちは、「新しい治療法・予防法」を見つけることで、人々の健康と未来に貢献することを目指しています。
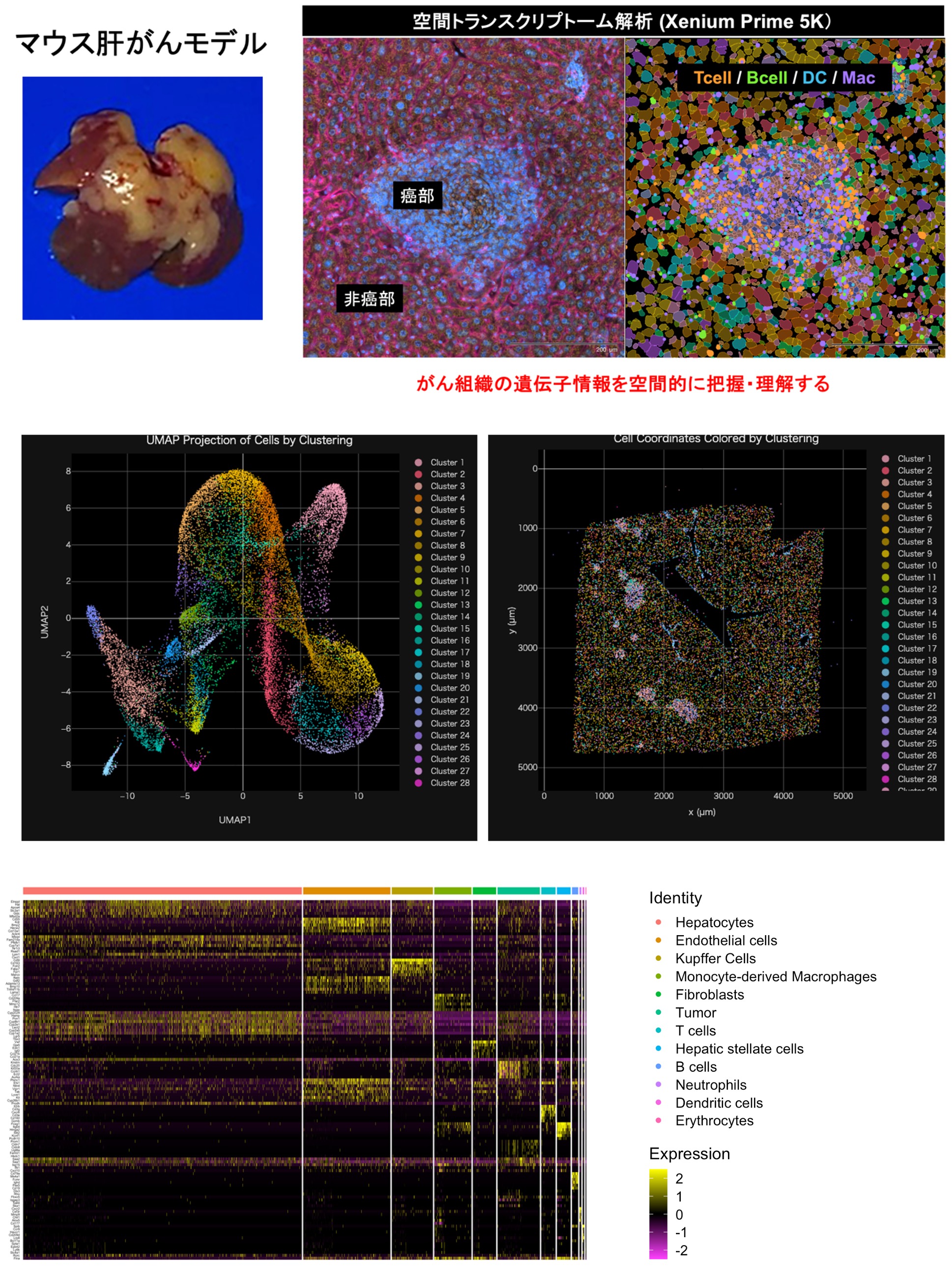
- 🧫 がん免疫研究 〜肝がんの免疫微小環境を解き明かす!〜
肝細胞がんは、ウイルス感染・生活習慣病・慢性炎症を背景に進行します。
がん細胞だけでなく、がんの周囲を取り巻く免疫細胞・線維芽細胞・血管・サイトカインなどが、がんの成長や免疫回避に大きく関与しています。
私たちは、この**「免疫微小環境(Tumor Immune Microenvironment)」**に注目し、がん免疫のしくみを分子レベルで解明しようとしています。
💊 注目の研究テーマ:免疫チェックポイント阻害剤の効果と限界に挑む
がん免疫療法の中でも、今もっとも注目されているのが**「免疫チェックポイント阻害剤(ICIs)」**です。
- PD-1 / PD-L1経路やCTLA-4経路を標的とした抗体医薬により、免疫細胞の「ブレーキ」を解除し、がんに立ち向かう力を取り戻すことができます。
- しかし、肝がんにおける奏効率は限定的であり、なぜ効かないのか?誰に効くのか? という問いが残されています。
私たちは以下のような研究を進めています:
- 肝がん患者由来サンプルを用いた免疫細胞の解析
- マウスモデルを用いた免疫環境の再現と治療効果の検証
- 空間情報解析やRNA-seq・フローサイトメトリーによる免疫細胞の分布・状態の解明
- **ICIsと他の薬剤との併用療法(コンビネーション治療)**の可能性探索
🌟 目指すゴール
- ICIsが効く人・効かない人の違いを明らかにし、個別化医療に貢献する
- 新たな治療ターゲットや併用療法の開発
- 肝がんの免疫回避メカニズムを“見える化”して、新たな免疫療法の基盤をつくる
- 🦠 感染症免疫研究
~目に見えない脅威から体を守る「センサー」の謎を解き明かす!~
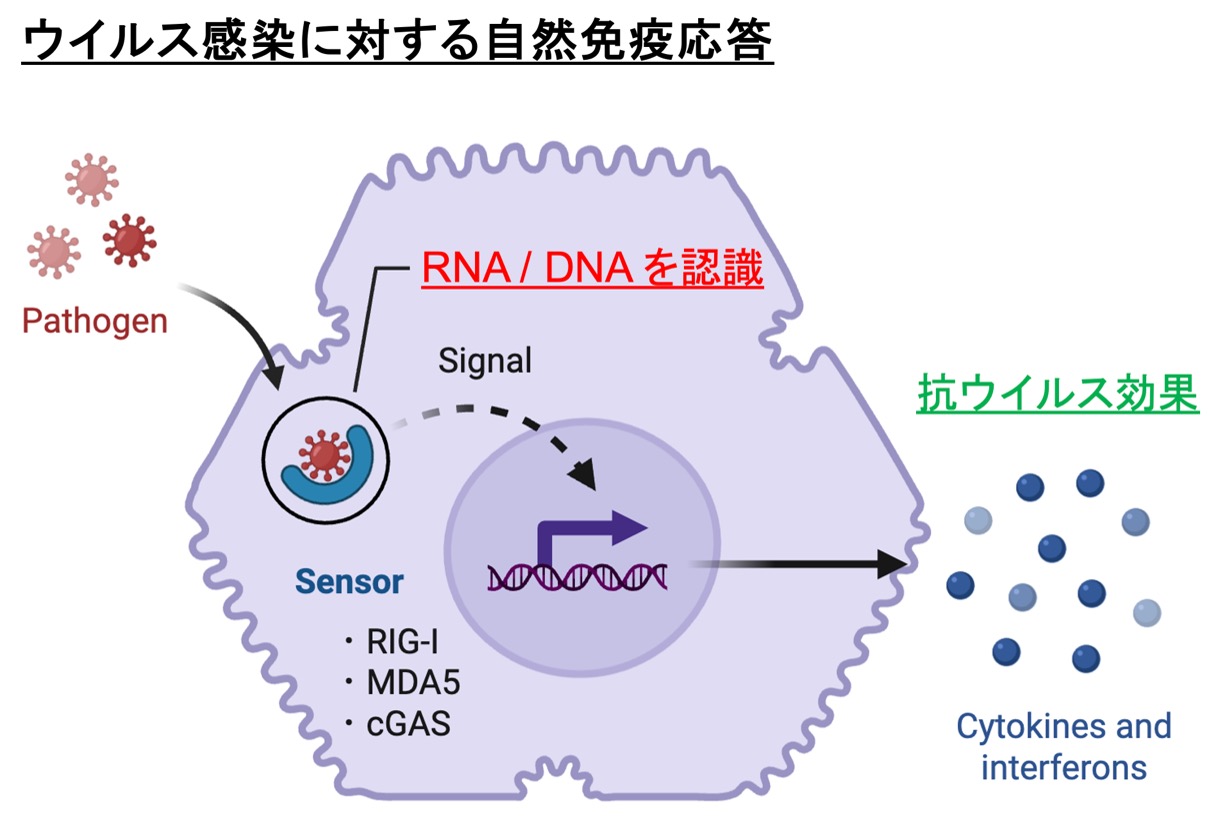
🔍 なぜ今、「センサー」に注目するのか?
私たちの体は、ウイルスや細菌といった病原体の侵入をいち早く検知し、防御反応を始める「センサー」を備えています。
この病原体認識のしくみは、感染防御だけでなく、がんや自己免疫疾患の発症とも深く関わっています。一つの発見が、感染症だけでなく、がん、自己免疫疾患、アレルギーなど、様々な病気の新しい治療法や予防法の開発に繋がる可能性があります。
とくに注目しているのは、ウイルス由来のRNAやDNAを感知する**「自然免疫センサー」**。
その構造や働きを解明することで、感染症の診断・予防・治療の鍵を握る新たな知見が得られると考えています。
🧬 研究の中心テーマ:「RNAセンサー」「DNAセンサー」のメカニズムを探る
- RIG-I / MDA5:RNAウイルス(インフルエンザ、SARS-CoV-2など)に反応するセンサー
- cGAS / STING経路:DNAウイルス(ヘルペスウイルスなど)を検出する主要経路
どのようにして「自己」と「非自己」を見分けるのか?
センサーが作動するとどんな信号が細胞内で起こるのか?
こうした問いに分子レベルで答えることが、私たちの研究の目的です。
🧪 主なアプローチと技術
- ウイルス感染細胞モデルを用いたセンサー活性化の観察(Luciferase assay, IFN測定など)
- 遺伝子改変細胞やノックダウン系を使った機能解析
- 免疫染色・共焦点顕微鏡によるセンサーの局在と動態解析
- RNA-seqやプロテオミクスで下流応答の全体像を把握
- 新規センサー候補のスクリーニングと機能検証
🌍 この研究が目指すもの
- 生命の根源的な防御システムである「免疫」の謎に、最先端の技術と知識を駆使して挑戦する
- 感染症に対する免疫のしくみを科学的に理解し、次世代のワクチン開発や治療薬設計に役立てる
- RNA/DNAセンサーがどのように敵を認識し、どのように警報を鳴らして免疫システム全体を動かすのか、そのメカニズムを分子レベルで明らかにする
- 将来的には、「免疫センサーを操作する医療」への応用を目指す
これまでの業績
論文
- Functional involvement of endothelial lipase in hepatitis B virus infection. Shirasaki T, Murai K, Ishida A, Kuroki K, Kawaguchi K, Wang Y, Yamanaka S, Yasukawa R, Kawasaki N, Li YY, Shimakami T, Nio K, Sugimoto S, Orita N, Takayama H, Okada H, huong Doan Thi Bich, Iwabuchi S, Hashimoto S, Ide M, Tabata N, Ito S, Matsushima K, Yanagawa H, Yamashita T, Kaneko S, Honda M.
Hepatology Communications. 2023 (in press) - Hepatitis B virus utilizes a retrograde trafficking route via the trans-Golgi network to avoid lysosomal degradation. Li YY, Kuroki K, Shimakami T, Murai K, Kawaguchi K, Shirasaki T, Nio K, Sugimoto S, Nishikawa T, Okada H, Orita N, Takayama H, Wang Y, Phuong Doan Thi Bich, Ishida A, Iwabuchi S, Hashimoto S, Shimaoka T, Tabata N, Watanabe-Takahashi M, Nishikawa K, Yanagawa H, Seiki M, Matsushima K, Yamashita T, Kaneko S, Honda M.
Cell Mol Gastroenterology Hepatology. 2023;15(3):533-558. - Leukocyte cell-derived chemotaxin 2 is an antiviral regulator acting through the proto-oncogene MET.
Shirasaki T, Yamagoe S, Shimakami T, Murai K, Imamura R, Ishii KA, Takayama H, Matsumoto Y, Shirasaki N, Nagata N, Shimizu R, Yamanaka S, Abe A, Omura H, Kawaguchi K, Okada H, Yamashita T, Yoshikawa T, Takimoto K, Taharaguchi M, Takatsuka S, Miyazaki Y, Tamai T, Tanabe Y, Kurachi M, Yamamoto Y, Kaneko S, Matsumoto K, Takamura T, Honda M.
Nature Communications. 2022 Jun 8;13(1):3176.
*AMEDホームページに掲載 https://www.amed.go.jp/news/seika/kenkyu/20220629-01.html - A Single HBV Genome with a Reporter Allows the Entire Viral Life Cycle to be Monitored in Primary Human Hepatocytes.
Sumiyadorj A, Murai K, Shimakami T, Kuroki K, Nishikawa T, Kakuya M, Yamada A, Wang Y, Ishida A, Shirasaki T, Kawase S, Li YY, Okada H, Nio K, Kawaguchi K, Yamashita T, Sakai Y, Duger D, Mizukoshi E, Honda M, Kaneko S.
Hepatology Communications. 2022 6(9):2441-2454. - Establishment of liver tumor cell lines from atherogenic and high fat diet fed hepatitis C virus transgenic mice.
Shirasaki T, Murai K, Honda M, Okada H, Innami Y, Yamada A, Shimakami T, Kawaguchi K, Yamashita T, Sakai Y, Kaneko S.
Scientific Reports. 2021 Jun 22;11(1):13021 - Induction of Selenoprotein P mRNA during Hepatitis C Virus Infection Inhibits RIG-I-Mediated Antiviral Immunity.
Murai K, Honda M, Shirasaki T, Shimakami T, Omura H, Misu H, Kita Y, Takeshita Y, Ishii KA, Takamura T, Urabe T, Shimizu R, Okada H, Yamashita T, Sakai Y, Kaneko S.
Cell Host & Microbe. 2019 Apr 10;25(4):588-601.e7.
*AMEDホームページに掲載 https://www.amed.go.jp/news/release_20190411.html - Unexpected Replication Boost by Simeprevir for Simeprevir-resistant Variants in Genotype 1a Hepatitis C Virus. Murai K, Shimakami T, Welsch C, Shirasaki T, Liu F, Kitabayashi J, Tanaka S, Funaki M, Omura H, Nishikawa T, Sumiyadorj A, Honda M, Kaneko S.
Antimicrobial Agents and Chemotherapy. 2018 Apr 16. pii: AAC.02601-17. - Peretinoin, an Acyclic Retinoid, Inhibits Hepatitis B Virus Replication by Suppressing Sphingosine Metabolic Pathway In Vitro.
Murai K, Shirasaki T, Honda M, Shimizu R, Shimakami T, Nakasho S, Shirasaki N, Okada H, Sakai Y, Yamashita T, Kaneko S.
International Journal of Molecular Sciences. 2018 Jan 23;19(2):108.
特許
- 宿主因子DENND2Aをターゲットとした抗B型肝炎ウイルス剤 (特願2022-040465)
- B型肝炎ウイルスのLIPGを介した細胞内侵入を阻害する抗B型肝炎ウイルス剤 (特願2021-121446)
- 宿主因子DOCK11をターゲットとした抗B型肝炎ウイルス剤 (特願2021-187544)
- HiBiTを利用したB型肝炎ウイルス複製モニタリングシステム (特許番号:特許第7606203号))
- 細胞癌株、およびそれを用いた原発性肝癌の発症動物モデル (特許第7038998)
獲得研究費
- 科学研究費助成事業・基盤研究(C) (2024-2026) 代表
「B型肝炎ウイルスRNAを制御する宿主因子の機能解析」 - AMED (肝炎等克服緊急対策研究事業) (2023-2025) 代表
「がん細胞代謝の理解に基づく肝がん免疫抑制機構の本態解明」 - 科学研究費助成事業・基盤研究(B) (2023-2025) 分担
「新規モニタリング法の確立によるB型肝炎ウイルスを完全駆除する薬物の探索と同定」 - 科学研究費助成事業・若手研究 (2022-2023) 代表
「シングルセルマルチオミックス解析による肝がん微小環境の解明」 - AMED (肝炎等克服緊急対策研究事業) (2020-2022) 代表
「肝がん微小環境の研究基盤の確立と新規免疫治療標的の探索」 - 科学研究費助成事業・国際共同研究強化(B) (2020-2024) 分担
「B型・D型肝炎ウイルス共感染が引き起こす肝疾患の分子生物学的機序の解明」 - 科学研究費助成事業・若手研究 (2019-2021) 代表
「RIP-Seq法を用いたRIG-IのRNA decoy探索と核酸医薬への応用」
受賞歴
- 公益財団法人 日揮・実吉奨学会研究助成 (2024)
- 第一三共「はばたく次世代」応援寄付プログラム (2023)
- 公益財団法人 持田記念医学薬学振興財団研究助成 (2023)
- 公益財団法人 安田記念医学財団 若手癌研究助成 (2022)
- 公益財団法人 武田科学振興財団 医学系研究助成 (2022)
- 公益財団法人 アステラス病態代謝研究会 第51回研究報告会 最優秀理事長賞 (2021)
- 北陸銀行若手研究者助成金 (2021)
- 公益財団法人 北國がん基金研究助成 (2020)
- 公益財団法人 アステラス病態代謝研究会研究助成 (2019)
- 公益財団法人「喜・榮・音與」支援財団研究助成 (2019)
- ギリアド研究助成プログラム (2018)
- GSK ジャパン研究助成 (2018)
- 国立大学臨床検査学系博士後期課程優秀賞 (2018)
- International Symposium on Hepatitis C Virus and Related Viruses 2016 Fellowship (2016)
研究室からのアピール
✨ ここで学べるスキルと成長機会
🔬 実験テクニック(最先端の研究を体験):
- 培養細胞を使った分子生物学実験(遺伝子導入、オミクス解析など)
- マウスを用いたin vivo実験(肝疾患モデルの解析)
- 臨床サンプル解析(患者さん由来の検体を用いた研究)
🎓 得られる知識と将来性
- 医学・生命科学の幅広い理解と応用力
- 基礎から応用(創薬・診断技術)まで対応できる実践力
- 研究者、製薬・バイオ企業、など多様なキャリアに直結!
🤝 研究室の雰囲気:あたたかく、刺激的な環境
- 先生・先輩・後輩との距離が近く相談しやすい!
- 週1の勉強会や定期的な研究発表会で、互いに切磋琢磨
- 研究が行き詰まったときも、みんなで解決を支え合う文化があります
🌍 メンバー構成(2025年5月現在)
課程 人数
博士後期課程 6名 (うち留学生3名)
博士前期課程 9名
学部卒研生 4名
合計 19名 (多様なバックグラウンドの仲間が在籍!)
将来の夢もさまざま:研究職、バイオ企業、海外進出など多彩な目標を持つ仲間が集まっています!
🎓 卒業後の進路とキャリア支援も充実!
- 8〜9割の学生がバイオ系企業・製薬企業へ就職!
- アカデミアで研究職として活躍する先輩も多数
- 経済的支援制度の採択実績も豊富:
✅ 「次世代研究者挑戦的研究プログラム(SPRING)」採択者:3名
✅ 「博士研究人材支援・研究力強化戦略PJ予約採用」:1名
研究に集中できる環境で、安心してステップアップできます!
💬 研究室からのメッセージ
🔥 「誰かを救う研究がしたい」そんな情熱を持つあなたへ
多様な仲間と出会い、世界につながる研究を一緒に始めてみませんか?
- まずは見学からでもOK!
- 質問・相談はいつでも大歓迎!
- 一歩を踏み出せば、きっと未来が開けます✨
📧 お問い合わせ・見学希望はこちらから!
本多・村居 研究室
📍 金沢大学 医薬保健研究域 保健学系
📨 [村居和寿: ]
]